2017年4月20日,厦门大学医学院国家杰出青年科学基金获得者王海滨教授率领的生殖调控团队在《美国科学院院报》(Proceedings of the National Academy of Sciences of the United States of America,缩写PNAS)上在线发表了一篇文章: “Nuclear Shp2 directs normal embryo implantation via facilitating the ERα tyrosine phosphorylation by the Src kinase”, 揭示了子宫中酪氨酸磷酸酶Shp2调节子宫内膜容受性建立的新机制。
受精的胚胎在发育到囊胚阶段后,需要附植到子宫内膜以建立稳固的生理学联系,这个过程称为胚胎植入,是胎儿发育成功的关键事件之一。临床上75%以上的早期妊娠失败或流产都是由异常的胚胎植入造成。胚胎植入的成功需要子宫内膜建立容受性,这主要取决于子宫内膜细胞在雌、孕激素,以及大量局部因子的协同调控下,不同类型内膜细胞发生准确的应答和分化。涉及其中的机制非常复杂,许多关键环节还有待认识。
王海滨教授率领的生殖调控团队利用动物胚胎植入模型和转基因模式动物,最近发现一个关键的调控蛋白-酪氨酸磷酸酶Shp2,将它在子宫内膜细胞中特异敲除,可造成胚胎植入完全失败,雌性小鼠不育;机制研究发现,缺失Shp2阻断了子宫内膜基质细胞中的雌激素信号活性。进一步研究发现,Shp2并不像在其他细胞中主要定位于细胞质发挥功能,而是需要进入细胞核中结合雌激素受体,募集并调控Src信号蛋白对雌激素受体(ER)的活化,最终影响雌激素受体靶蛋白的转录,其中包括对子宫接受态建立关键的孕激素受体(PR)的表达调控。
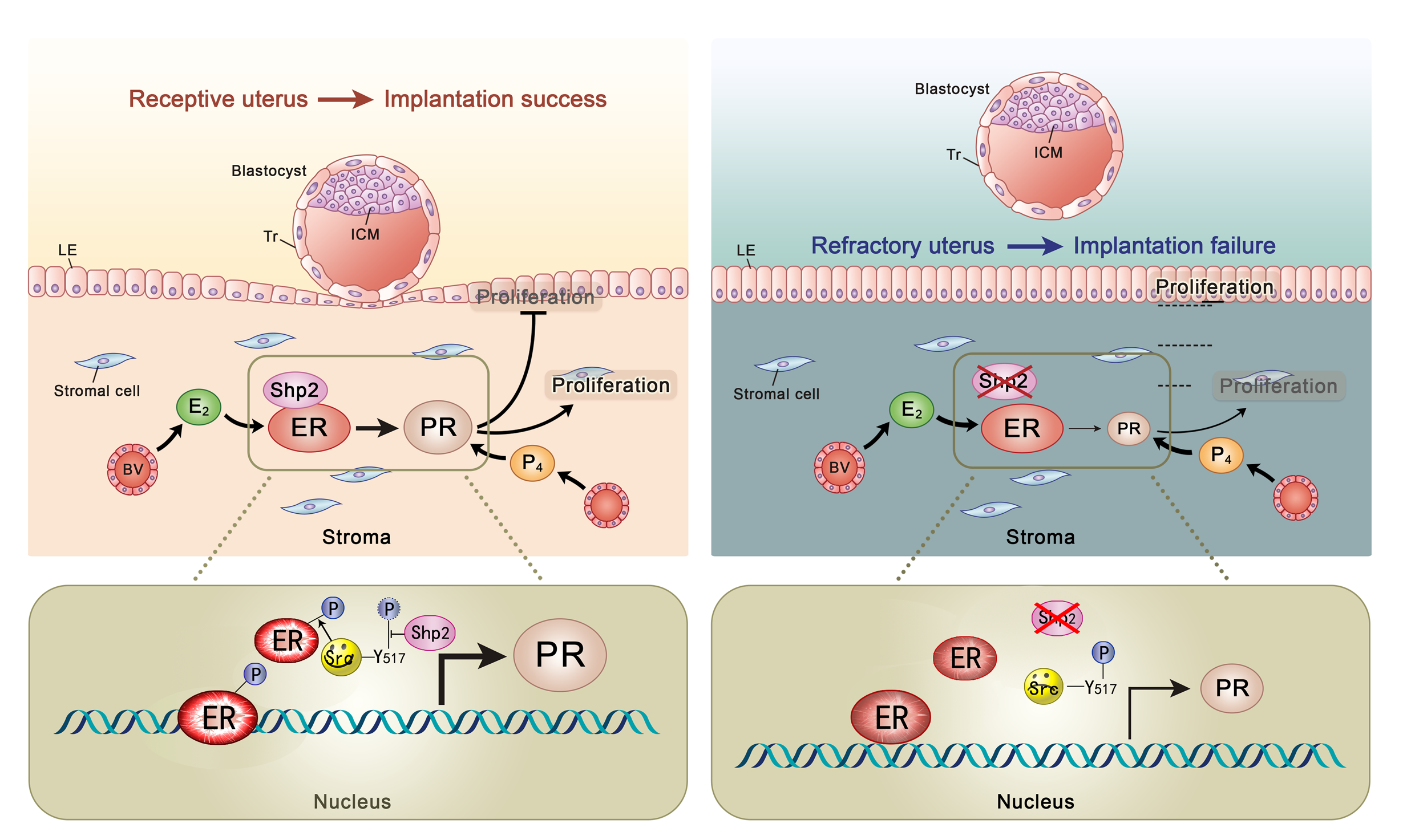
子宫Shp2通过激酶Src参与调控雌激素受体ER转录活性和子宫容受态建立的示意图
以上结果发现了子宫中Shp2发挥作用的新机制,即Shp2主要依赖细胞核定位的部分,通过促进雌激素受体ER的活性发挥胚胎植入不可或缺的作用;同时对于认识雌、孕激素调控内膜容受态的建立也提供新的思路。
本文共同通讯作者是王海滨教授、药学院吕忠显教授和中国农业大学王超博士。本研究主要受国家自然基金委重点项目等支持(王海滨:81130009, 81330017, 81490744;孔双博:81601285;张爽:31471106)。
文章链接 :
http://www.pnas.org/content/early/2017/04/18/1700978114.full.pdf?with-ds=yes
(医学院生殖调控团队)